Сколько нуклонов протонов и нейтронов содержится в ядре магния

Примеры обозначения нуклидов:. Массы протона, нейтрона и ядра дейтерия равны соответственно 1, а. Электромагнитное взаимодействие.
Теперь мы можем сформулировать окончательное определение понятия " химический элемент". Так как заряд ядра определяется числом протонов, то химическим элементом можно назвать совокупность нуклидов с одинаковым числом протонов. Вспомнив сказанное в начале параграфа, мы можем уточнить один из важнейших химических законов. При химических реакциях и при физических взаимодействиях, не затрагивающих ядра нуклиды не возникают, не исчезают и не превращаются друг в друга.
У нуклидов одного элемента число нейтронов в ядре может быть одинаковым, а может и отличаться. Поэтому и массовые числа нуклидов одного элемента могут быть разными. Примеры нуклидов одного элемента с разными массовыми числами — различные устойчивые нуклиды олова, характеристики которых приведены в табл.
У нуклидов с одинаковыми массовыми числами масса одинакова, а у нуклидов с разными массовыми числами — разная. Отсюда следует, что атомы одного элемента могут отличаться по массе.
Изотоп — совокупность нуклидов одного элемента с одинаковым массовым числом. Следовательно, у нуклидов одного изотопа одинаковое число протонов так как это один элемент , одинаковое число нейтронов так как это один изотоп и, естественно, одинаковая масса. Такие нуклиды совершенно одинаковы и потому принципиально неразличимы. В физике под словом "изотоп" иногда подразумевают и одинт нуклид данного изотопа.
Нуклиды разных изотопов одного элемента отличаются массовыми числами, то есть числами нейтронов, и массой. Общее число известных ученым нуклидов приближается к Из них устойчивы, то есть существуют в природе, около Элементов в настоящее время, включая искусственно полученные, известно Среди нуклидов физики выделяют изобары - нуклиды с одинаковой массой независимо от заряда Многие элементы имеют по одному природному изотопу, например, Be, F, Nа, Al, P, Mn, Co, I, Au и некоторые другие.
Но большинство элементов имеют по два, по три и более устойчивых изотопа.
Для описания состава атомных ядер иногда рассчитывают доли протонов или нейтронов в этих ядрах. В нашей формуле это означает, что суммируются числа всех объектов: от первого N 1 до последнего N n. В коробке лежат 5 зеленых карандашей, 3 красных и 2 синих; требуется определить долю красных карандашей. Определите долю протонов в ядре атома. Определите долю нейтронов в этом ядре. Какова доля нейтронов в ядрах нуклидов 3. Массовое число нуклида равно Нуклидом какого элемента является данный нуклид?
В ядре нуклида доля нейтронов 0, Определите Z. Во сколько раз масса атома тяжелого изотопа урана 92 U, содержащего нейтронов в ядре, больше массы атома легкого изотопа урана, содержащего в ядре нейтронов? Из количественных характеристик атома вам уже знакомы массовое число, число нейтронов в ядре, число протонов в ядре и заряд ядра. Так как заряд протона равен элементарному положительному заряду, то число протонов в ядре Z и заряд этого ядра q я , выраженный в элементарных электрических зарядах, численно равны.

Поэтому, как и число протонов, заряд ядра обычно обозначают буквой Z. Число протонов одинаково для всех нуклидов какого-либо элемента, поэтому оно может использоваться как характеристика этого элемента. В этом случае оно называется атомным номером. Так как электрон "легче" любого из нуклонов почти в раз, масса атома m o сосредоточена прежде всего в ядре. Ее можно измерять в килограммах, но это очень неудобно.
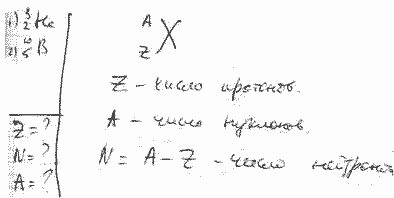
Например, масса самого легкого атома — атома водорода — равна 1, Действительно, неудобно. Поэтому в качестве единицы измерений масс атомов используется специальная атомная единица массы, для которой знаменитый американский химик Лайнус Полинг — предложил название " дальтон". Атомная единица массы с точностью, достаточной в химии, равна массе любого нуклона и близка к массе атома водорода, ядро которого состоит из одного протона. В м классе из курса физики вы узнаете, почему она в действительности несколько меньше массы любой из этих частиц.
Из соображений удобства измерений атомная единица массы определяется через массу нуклида самого распространенного изотопа углерода. Обозначение атомной единицы массы — а. Если массу атома измеряют в дальтонах, то по традиции ее называют не " масса атома" , а атомная масса. Масса атома и атомная масса — одна и та же физическая величина. Так как речь идет о массе одного атома нуклида , то ее называют атомной массой нуклида.
Обозначается атомная масса нуклида буквами А r с указанием символа нуклида, например: А r 16 O — атомная масса нуклида 16 O, A r 35 Cl — атомная масса нуклида 35 Сl, A r 27 Аl — атомная масса нуклида 27 Аl. Если у элемента есть несколько изотопов, то этот элемент состоит из нуклидов с разной массой. В природе изотопный состав элементов обычно постоянен, поэтому для каждого элемента можно посчитать среднюю массу атомов этого элемента :.
Если среднюю массу атомов элемента измеряют в дальтонах, то в этом случае ее называют атомной массой элемента. Атомная масса элемента — средняя масса атомов элемента в природной смеси изотопов этого элемента, выраженная в атомных единицах массы дальтонах. Обозначается атомная масса элемента так же, как и атомная масса нуклида, буквами А r , но в скобках указывается не символ нуклида, а символ соответствующего элемента, например: А r O — атомная масса кислорода, А r Сl — атомная масса хлора, А r Аl - атомная масса алюминия.
Так как атомная масса элемента и средняя масса атома этого элемента — одна и та же физическая величина, выраженная в разных единицах измерений, то и формула для вычисления атомной массы элемента аналогична формуле для вычисления средней массы атомов этого элемента:. Какова доля протонов в ядре каждого из этих атомов? Запишите символы этих нуклидов. На этом примере докажите, что " доля не зависит от порции" , то есть, что доля атомов водорода в любой порции воды равна доле атомов водорода в одной молекуле этого вещества.
Атомная масса аргона — 39, Дн. Определите, в каком соотношении встречаются в природе 38 Аr и 40 Аr. Атомная масса магния — 24, Дн. Определите доли остальных двух изотопов магния с массовыми числами 24 и За время около 1 пс этот уровень распадается на основной уровень с испусканием гамма-кванта, уносящего почти всю энергию.
Гамма-кванты с энергией 1,46 МэВ обладают высокой проникающей способностью, и поскольку калий является одним из самых распространённых химических элементов, испускаемые при распаде калия гамма-кванты вносят существенный вклад в дозу внешнего облучения человека.
Это объясняется тем, что лишь небольшая часть земного аргона захвачена при образовании планеты; почти весь аргон, содержащийся в земной атмосфере и недрах, является радиогенным — образован в результате постепенного распада калия [6]. Калий естественно присутствует в живых организмах наряду с двумя другими стабильными природными изотопами калия.
Присутствие калия в теле человека вызывает природную и неустранимую, но при этом не представляющую опасность для жизни и здоровья человека радиоактивность человеческого организма от этого изотопа, составляющую 4—5 кБк [7] в зависимости от пола и возраста [8] , удельное содержание калия может варьировать. Среднегодовая эффективная эквивалентная доза, получаемая человеком в результате распада калия в тканях организма, составляет мкЗв [9] ; внешняя среднегодовая доза от этого радионуклида в районах с нормальным фоном составляет в среднем мкЗв , тогда как суммарная среднемировая годовая доза от всех источников ионизирующего излучения оценивается в мкЗв [9].
Отказ от употребления калия с пищей вызывает гипокалиемию , что очень опасно для здоровья и может привести к смерти , в то же время естественная радиоактивность калия не представляет опасности для жизни и здоровья человека.
Калий необходим для жизни живых организмов, в том числе и человека, и является важным макроэлементом наряду с соединениями натрия , кальция , фосфора , магния , хлора и серы.
Отношение концентрации 40 K к концентрации его продукта распада 40 Ar используется для определения абсолютного возраста объектов методом так называемого калий-аргонного датирования. Суть этого метода состоит в следующем:.

Материал из Википедии — свободной энциклопедии. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии , проверенной 29 мая года; проверки требуют 6 правок.
Tables, graphs, and references англ. The Nubase evaluation of nuclear properties англ.

On the emission of negative corpuscles by the alkali metals англ. Elemental and isotopic abundances of the volatile elements in the outer planets англ.