Схема образования химической связи, Урок химии по теме "Химическая связь. Электронная схема образования ковалентной связи"

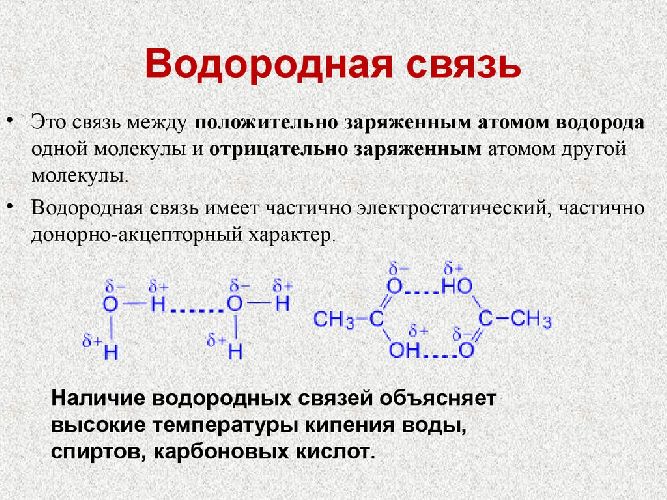
Ионная связь является одним из 4 основных видов химической связи. Удобная навигация, видео-разборы тем, задачи для самопроверки — всё это в вашем кармане. Существование водородных связей между молекулами этих соединений обусловливает аномально высокие температуры кипения и плавления этих веществ по сравнению с соответствующими водородными соединениями элементов этих же групп периодической таблицы Д.
Гайтлером и Ф. Лондоном как эффект перекрывания электронных плотностей атомных орбиталей взаимодействующих атомов. В рамках этой теории теория валентных схем образование валентной связи между двумя атомами обусловлено взаимной компенсацией спинов их валентных электронов, причём получающаяся электронная пара входит во внешние электронные оболочки обоих атомов.
Связывающую электронную пару первоначально представляли двумя точками, расположенными между двумя атомами молекулы. С появлением теории валентных схем и открытием спина электрона, электронную пару стали представлять двумя параллельными стрелками, направленными в противоположные стороны и расположенные в области перекрытия атомных орбиталей рис.
В рамках теории валентных схем атом углерода в алканах , например, в метане , был окружён четырьмя связывающими электронными парами рис.
В теории молекулярных орбиталей связывающую электронную пару стали представлять в форме контурных карт электронной плотности. На рис. Во всех случаях связывающая электронная пара или электронная плотность концентрируется на линии, соединяющей ядра молекулы.
Для описания химических соединений с кратными связями Л. Позднее, на симпозиуме, посвящённом памяти Кекуле Лондон, сентябрь г. Двойная связь представляется как комбинация двух, а тройная — трёх одинаковых изогнутых химических связей. В теории отталкивания электронных пар три связывающие электронные пары тройной связи представлены в виде трёх сплющенных сфер, дающих форму диска или сплющенного эллипсоида, расположенных вокруг линии, соединяющей ядра атомов молекулы ацетилена рис.
Теория изогнутой химической связи и теория отталкивания электронных пар, в отличие от теории валентных связей и теории молекулярных орбиталей, учитывали электростатическое отталкивание электронов.
Электростатическое отталкивание электронов непосредственно в связывающей электронной паре было заложено в боровской химической связи. Нильс Бор представлял электронную пару в форму кольца электронов.
В метане, по Бору:. Материал из Википедии — свободной энциклопедии. Эволюция представления об электронной паре [ править править код ] Рис. Спин-спиновое взаимодействие электронов в связывающей электронной паре Рис. Модель молекулы метана , образованной sp 3 -гибридными орбиталями Рис. Контурная карта электронной плотности для молекулы водорода Связывающую электронную пару первоначально представляли двумя точками, расположенными между двумя атомами молекулы. Молекулы газообразного водорода, сероводорода, аммиака, метана и метанола метилового спирта имеют следующие структурные формулы:.
Структурная формула молекулы лишь схематично изображает связи между атомами, но не дает информации о реальной форме молекулы. Заметим, что угол между связями в молекулах, содержащих более двух атомов, может принимать различные значения. Структурная формула неразветвленного октана, одного из компонентов бензина, такова:.
Изображение ниже дает более реальное представление о форме и относительном объеме некоторых простых молекул. Каждая пара связанных атомов как бы проникает друг в друга, потому что их электронные облака перекрываются между собой. Принято изображать молекулы таким образом, что расширяющаяся линия указывает связь, направленную от плоскости рисунка в сторону наблюдателя, а пунктирная линия указывает связь, уходящую за плоскость рисунка в сторону от наблюдателя.
Каждая из указанных выше структурных формул может быть сведена к сжатой молекулярной формуле, которая указывает, сколько атомов каждого элемента имеется в молекуле, но совсем или почти совсем не дает сведений о том, как эти атомы соединены между собой.
Формула октана может быть также записана в такой форме:.

Под молекулярной массой вещества понимается масса молекулы, вычисленная через сумму всех атомных масс, входящих в нее атомов; измеряется, как и атомная масса, в а. Если молекулярную массу вещества вычислять через относительные атомные массы, то и называться масса молекулы будет относительной молекулярной массой вещества.
Относительная молекулярная масса — величина безразмерная. Пример 1: Какая относительная молекулярная масса у воды? Решение: Заходим в таблицу Менделеева и выписываем относительные атомные массы водорода и кислорода, округляя до целого значения. Так как молекулярная формула воды имеет вид H 2 O, то ее молекулярная масса равна:. Пример 2: Вычислите молекулярную массу метанола метилового спирта.
В примере 2 следует обратить внимание на то, что естественная атомная масса углерода равна не 12,, а 12, а. Пример 3: Чему равна молекулярная масса чистого октана? Решение: Молекулярная формула октана С 8 Н 18 , поэтому его молекулярная масса равна. Надеюсь урок 3 « Схема образования молекул » был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Содержание Молекулы состоят из атомов Связь атомов в молекулах Ковалентная химическая связь Молекулярная и структурная формула Относительная молекулярная масса вещества.